 当前位置:首页 > 客户专区 > 常见问题
当前位置:首页 > 客户专区 > 常见问题  产品中心
产品中心 
 当前位置:首页 > 客户专区 > 常见问题
当前位置:首页 > 客户专区 > 常见问题 一、液体样本
液体样本处理原则:所有的液体样本,用无菌管收集,2-8℃条件离心20分钟左右(2000-3000转/分),如果以后碰到其他的液体样本,也按这个方法,纳入汇总表。
1、血清:用无菌管收集,室温血液自然凝固10-20分钟,2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如出现沉淀,应再次离心。
2、血浆:应根据标本的要求选择EDTA、肝素钠或柠檬酸钠作为抗凝剂,混合10-20分钟后,2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3、尿液:用无菌管收集,2-8℃条件离心20分钟左右(2000-3000转/分)。仔细收集上清,保存过程中如有沉淀形成,应再次离心。
4、胸腹水:用无菌管收集,2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如有沉淀形成,应再次离心。
5、脑脊液:用无菌管收集,2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如有沉淀形成,应再次离心。((采集大鼠脑脊液)的方法:采集脑脊液时,用湿纱布擦试大鼠颈背部皮肤,剪去背毛暴露皮肤。两耳连线剪一横切口((1. 5cm左右),在其中点向尾侧沿皮下剪开2cm,将皮分离两侧,扩大视野。紧贴大鼠头骨依次逐层剪切各肌层,并断端依次拉向尾侧扩大视野。注意,有出血时用干纱布按压止血,保持术口清晰。接近颈后黄韧带时,小心地用7号注射针头分离附盖的肌肉,暴露寰枕膜。用lml注射器(针头用止血钳使针尖与针体成150度钝角),针斜面向上,针尖端近水平刺入蛛网膜下腔,固定针体,缓慢抽取脑脊液,一般采集量为100-200微升。)
6、唾液:用无菌管收集,2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如有沉淀形成,应再次离心。
7、细胞培养上清:检测分泌性的成份时,用无菌管收集。2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如有沉淀形成,应再次离心。
8、牛奶:用无菌管收集,2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如有沉淀形成,应再次离心。
9、蜂蜜:用无菌管收集,2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如有沉淀形成,应再次离心。
10、全血:用含有抗凝剂的无菌管收集,立即轻轻摇动,来回轻轻颠倒数次,使血液和抗凝剂混匀,以防血液凝固。
二、固体样本
固体样本处理原则:称取1g的固体样本,用9g的合适缓冲液溶解,分泌蛋白可以直接离心取上清检测,细胞内的蛋白,要先收集细胞,再用合适方法破碎,离心取上清测试。
1、组织标本:切割标本后,称取1g组织,加入9g的pH7.2-7.4左右的PBS,用手工或匀浆器将标本匀浆充分。离心20分钟左右(2000-3000转/分),仔细收集上清。分装一份待检测,其余冷冻备用,保存过程中如有沉淀形成,应再次离心。对于植物组织,不好匀浆的话,就在液氮中充分研磨;
2、细胞内蛋白样本
许多待测蛋白不是分泌蛋白,而是存在于细胞内的蛋白,这个时候,要先收集细胞,洗涤干净,再破碎细胞,离心取上清。
(1)培养的细胞
A、动物细胞:用PH7.2-7.4的PBS稀释细胞悬液,使细胞浓度达到100万/ml左右。通过反复冻融(如果反复冻融,破碎效果不好,就采用超声波破碎),以使细胞破坏并放出细胞内成份。2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如有沉淀形成,应再次离心。
B、植物细胞:用PH7.2-7.4的PBS稀释细胞悬液,使细胞浓度达到100万/ml左右,置于冰盒上,用超声破碎仪,设置破碎2s,冷却30s的方式,充分破碎细胞,以使细胞破坏并放出细胞内成份。2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清,保存过程中如有沉淀形成,应再次离心。
(2)组织的细胞
切割标本后,称取1g组织,加入9g的pH7.2-7.4左右的PBS,用手工或匀浆器将标本匀浆充分。2-8℃条件离心20分钟左右(2000-3000转/分),去除上清,再用pH7.2-7.4左右的PBS小心洗涤沉淀的细胞三遍。再用上述的细胞破碎方法破碎细胞。
3、土壤:称取1g土壤,加入9g的pH7.2-7.4左右的PBS,用手工将标本充分混匀。2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清。分装一份待检测,其余冷冻备用,保存过程中如有沉淀形成,应再次离心。如果是测分泌蛋白,直接取上清检测,测试细胞内蛋白,要破碎细胞。
4、咽拭子:加入2g的pH7.2-7.4左右的PBS,溶解咽拭子头部,摇匀,用镊子取出咽拭子并挤干液体,2-8℃条件离心20分钟左右(2000-3000转/分),仔细收集上清。分装一份待检测,其余冷冻备用,保存过程中如有沉淀形成,应再次离心。如果是测分泌蛋白,直接取上清检测,测试细胞内蛋白,要破碎细胞。
5. 植物标本的精采集及保存
1、 称取0.1g(误差±3%以内)新鲜植物组织样本,在液氮中充分研磨;
2、 加入1ml的提取液(80%甲醇), 置于-20度过夜;
3、 于4度,8000rpm,离心1小时,取上清;
4、 上清液过C-18固相萃取柱。具体步骤是: 80%甲醇(1ml)平衡柱→上样→收集样品→移开样品后用100%甲醇(5ml)洗柱→100%乙醚(5ml)洗柱→100%甲醇(5ml)洗柱→循环。过柱后的样本真空干燥或氮气吹干,保存备用;
5、 上样前加入pH7.4 PBS缓冲液(1ml定容)。混匀后室温放置30分钟,然后4度离心(8000rpm,15分钟),取上清并暂时保存于4度待用。
6.植物标本中相关酶或蛋白的测定:(粗提取)
1、 新鲜植物组织请在液氮中充分研磨;
2、 加入样品体积9倍的提取液(pH 7.4 PBS缓冲液),3、 请于4度,8000rpm,离心30分钟,取上清并暂时保存于4度待用。
三、样本收集注意事项
1、不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
2、标本采集后尽快进行实验,若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融。
3、我们罗列的是通用的样本处理方法,无法涵盖各种样本,对于一些特殊样本,建议实验人员多参考已发表的文献,自行设计合理的样本处理方法。
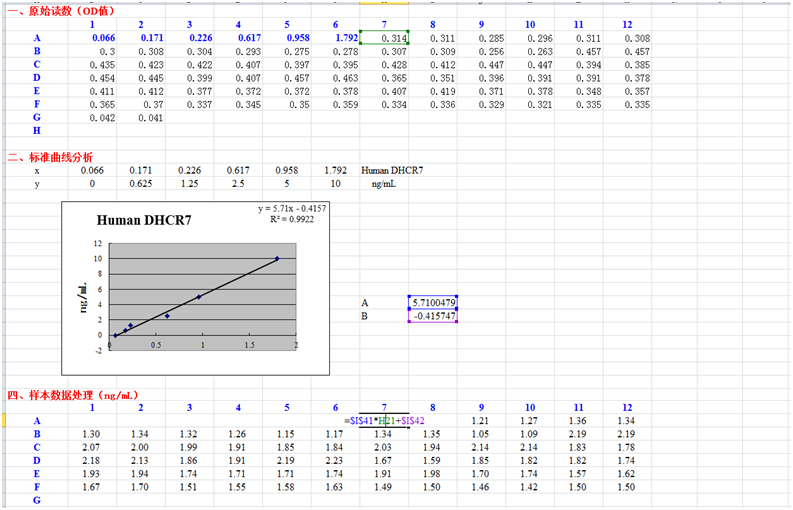
度作横坐标,对应OD值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样本浓度值。将样本的OD值为X值代入方程式,所得的Y值即是我们的样本值。(如上图所示)

 联系电话
联系电话
15321069687
 客服QQ
客服QQ
4072128
 公司邮箱
公司邮箱
mecenbio@163.com
 公司网址
公司网址
www.mecenbio.com
